El movimiento de los constituyentes de la materia, los cambios quûÙmicos y fûÙsicos y la formaciû°n de nuevas sustancias se originan gracias a cambios en la energûÙa del sistema; conceptualmente, la energûÙa es la capacidad para realizar un trabajo o transferir calor; la energûÙa a su vez se presenta como energûÙa calû°rica, energûÙa mecûÀnica, energûÙa quûÙmica, energûÙa elûˋctrica y energûÙa radiante; estos tipos de energûÙa pueden ser ademûÀs potencial o cinûˋtica. La energûÙa potencial es la que posee una sustancia debido a su posiciû°n espacial o composiciû°n quûÙmica y la energûÙa cinûˋtica es la que posee una sustancia debido a su movimiento.
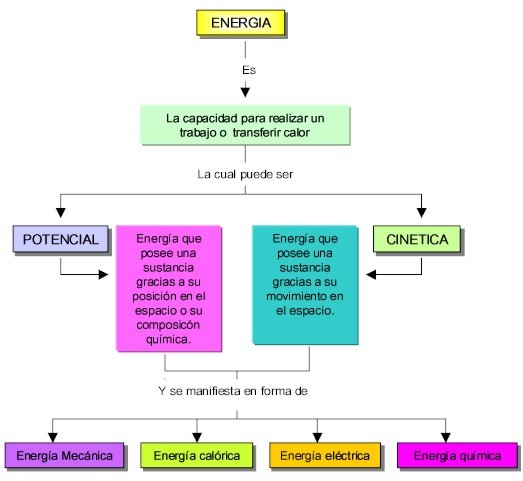
Tipos de energûÙa
Manifestaciones de la energûÙa
EnergûÙa MecûÀnica: El movimiento de las hûˋlices del molino de viento es transferido a un sistema mecûÀnico de piûÝones, para producir energûÙa elûˋctrica o lograr la ascensiû°n de agua de un pozo subterrûÀneo
EnergûÙa Calû°rica o radiante: El calor o la luz emitida desde el sol es aprovechada por las plantas para producir energûÙa quûÙmica en forma de carbohidratos.
EnergûÙa Elûˋctrica: El movimiento de electrones libres, produce la energûÙa elûˋctrica, usada para hacer funcionar electrodomûˋsticos, trenes, y artefactos industriales.
EnergûÙa QuûÙmica: La combustiû°n de hidrocarburos como el petrû°leo, liberan gran cantidad de energûÙa.
Formas de mediciû°n de la energûÙa
Poseer un referente de la cantidad de energûÙa que se intercambia en las diferentes interacciones de la materia requiere de patrones de mediciû°n. Como la forma de energûÙa que tiene mayor expresiû°n es la energûÙa calû°rica, entendida ûˋsta como la energûÙa que se intercambia entre dos sustancias cuando existe diferencias de temperatura entre ambas, trataremos las unidades de medida de esta.
La cantidad de energûÙa cedida o ganada por una sustancia se mide en calorûÙas o joules.
Una calorûÙa (cal) es igual a la cantidad de calor necesario para elevar de 14,5o C a 15,5o C 1 gramo de agua. Como factor de conversiû°n diremos que una calorûÙa equivale a 4,184 joules.
1 cal = 4,184 J

Es necesario diferenciar la calorûÙa utilizada como herramienta de mediciû°n de la energûÙa calû°rica en quûÙmica, de la calorûÙa utilizada en nutriciû°n, ya que la calorûÙa contenida en los alimentos (Cal) o gran calorûÙa, equivale a 1.000 calorûÙas o 1 KilocalorûÙa (Kcal).
2 cubos de azû¤car ( 10 g), contienen 37,5 Cal nutricionales, lo que equivale a 37,5 Kcal, 37.500 cal quûÙmicas y 156.900 j.
Calor especifico
ô¢Has sentido que unas sustancias se calientan con mayor rapidez que otras?, el calor especifico se relaciona con ello; conceptualmente, el calor especûÙfico es la cantidad de calor necesario para elevar la temperatura de una sustancia determinada; desde el punto de vista quûÙmico, 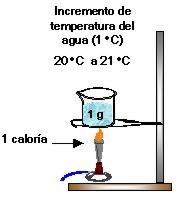 es la cantidad de calorûÙas requeridas para elevar en un grado centûÙgrado la temperatura de un gramo de una sustancia, o es el nû¤mero de joules requeridos para elevar en un grado kelvin la temperatura de un kg de una sustancia.
es la cantidad de calorûÙas requeridas para elevar en un grado centûÙgrado la temperatura de un gramo de una sustancia, o es el nû¤mero de joules requeridos para elevar en un grado kelvin la temperatura de un kg de una sustancia.
Calor EspecûÙfico del agua: 1 cal/g o C
Este valor significa que para elevar 1 grado centûÙgrado la temperatura de 1 g de agua, se requiere 1 calorûÙa.
Calor Especifico del Aluminio: 0,217 cal/g o C
Este valor significa que para elevar 1 grado centûÙgrado la temperatura de 1 g de Aluminio se requieren 0,217 calorûÙas.
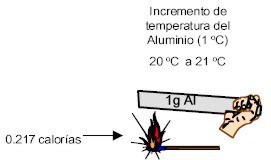
Valores comparativos del calor especifico del agua en estado lûÙquido y el aluminio en estado sû°lido.
Ley de la conservaciû°n de Masa-EnergûÙa
Para concluir esta parte temûÀtica, abordemos una pregunta: en el momento de ocurrir un cambio fûÙsico o quûÙmico (reacciû°n quûÙmica) en una sustancia, ô¢existe perdida de masa y/o energûÙa?
Antoine Laurent Lavoiser (743-1749) y James Prescott Joule (1818-1889), dedicaron parte de su trabajo cientûÙfico en la soluciû°n de este problema, llegando a la conclusiû°n de que en las reacciones quûÙmicas y en los cambios fûÙsicos las masas de las sustancias participantes no se crean ni destruyen, solo se transforman; esta conclusiû°n se conoce con el nombre de Ley de la conservaciû°n de la masa.
En este ejemplo de reacciû°n quûÙmica, 4.032 g de Hidrû°geno gaseoso, reaccionan con 141.812 g de cloro gaseoso, para formar 145.844 g de ûÀcido clorhûÙdrico.
La suma de los reactivos es igual a la suma de los productos.
La masa de los reactivos no se destruyû°, estos se combinaron y se transformaron en una nueva sustancia.
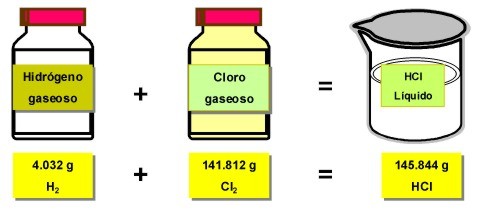
Ejemplo de la ley de la conservaciû°n de la materia: formaciû°n del ûÀcido clorhûÙdrico, mediante la reacciû°n del Hidrû°geno con el Cloro.